Инфекционный бронхит кур (ИБК) – это широко распространенное вирусное заболевание в Российской Федерации, к которому восприимчивы куры всех возрастов [2,3].
Основным источником инфекции являются больные и переболевшие птицы, которые длительный период времени остаются вирусоносителями.
Вирус ИБК – это РНК-содержащий вирус, который относится к семейству Coronaviridae, виду Coronavirus и характеризуется эпитеотропностью, размножается он в реснитчатом эпителии и клетках, секретирующих слизь. Основным местом репликации возбудителя инфекционного бронхита кур являются верхние дыхательные пути, затем вирус проникает в кровь и распространяется по всему организму [1-3, 6-8].
Тропизм возбудителя ИБК весьма широк, поэтому вирус продуцируется в респираторной системе, во многих отделах пищеварительного тракта, в почках, лимфоидных органах и яйцеводах.
Пневмотропные штаммы поражают респираторную систему, вызывая гибель птицы от дыхательной недостаточности, вторичных бактериальных инфекций (преимущественно колибактериозов) и сопутствующих вирусных заболеваний [3, 6-8].
Для бройлеров характерно течение ИБК чаще с поражением респираторной системы, проявляющееся бронхитом, пневмонией, трахеитом, а также с поражением почек в случае циркуляции нефропатогенных штаммов [2-3, 6-8].
Значительное антигенное разнообразие вируса ИБК приводит к тому, что иммунитет сформированный к одному серотипу, неактивен против инфекции другого серотипа вируса инфекционного бронхита кур[2,3].
Можно утверждать, что эффективность иммунизации птицы зависит напрямую от используемого вакцинного штамма, кратности вакцинации, способа введения вакцины, а также от однородности иммунного ответа. Но при этом на птицефабриках России всё же возникают вспышки инфекционного бронхита вне зависимости от вакцинации. Это свидетельствует о потребности в изучении лечения и нахождения наиболее эффективного способа введения препаратов.
На сегодняшний день выявление большого количества коронавирусов при электронной микроскопии кишечного содержимого может говорить о возникновении массовых респираторных инфекций, несмотря на первичную локализацию вируса в кишечнике. Основная масса коронавирусов у птиц, телят, поросят, собак, кошек локализуется в кишечнике и вызывает в первую очередь кишечные расстройства, но при этом вирус ИБК, а именно часть пневмотропных штаммов данного вируса, является наглядным исключением [1, 7].
Препараты с вироцидной и иммуномодулирующей активностью в тонком отделе кишечника (обычно мало специфичные) потенциально могут быть эффективны.
Сообщается о значении интерферонов в защите от коронавирусных заболеваний. Так, коронавирус способен препятствовать выработке интерферонов. Таким образом, использование препаратов-индукторов интерферона может снизить смертность от коронавирусной пневмонии на самых ранних стадиях заболевания. Указывается на ключевую роль интерферона-гамма, который назван главным противовирусным средством в период вирусных эпидемий и на потенциальное терапевтическое преимущество использования препаратов-индукторов интерферона (например, бактериального или растительного происхождения) одновременно с препаратом очищенного эндогенного интерферона-гамма. Отмечается, что природные индукторы интерферона способны увеличивать концентрацию интерферона после введения всего за несколько часов, в то время как синтетические аналоги – через 24-48 часов после введения.
Одними из эффективных индукторов интерферона являются препараты и иммуномодуляторы созданные на основе ослабленных или инактивированных бактерий или вирусов. Вирусы и бактерии относятся к природным индукторам интерферонов (INF) – защитных белков, которые блокируют размножение вируса.
Одним из перспективных направлений в настоящее время является разработка бактериальных иммуностимуляторов и иммуномодуляторов. Streptococcus pyogenes – это грамм-позитивные бактерии, компоненты клеток которых стимулируют врожденный иммунитет. К таким компонентам относится CpG ДНК стрептококков, пептидогликан клеточной стенки, липотейхоевые кислоты. Полисахариды и ДНК штамма Streptococcus pyogenes являются эффективными индукторами гамма-интерферона [17].
Липотейхоевые кислоты являются индуктором фактора некроза опухоли альфа, интерферонов-альфа, -бета и –гамма, стимулирует митогенез (деление клеток) Т-лимфоцитов и активирует систему комплемента.
Пептидогликан грампозитивных бактерий стимулирует выработку ФНО-альфа, ИЛ-8, ИЛ-1, ИЛ-6 и активирует митогенез В-лимфоцитов.
Бактериальная ДНК содержит неметилированные участки CpG которые связываются с Толл-подобными рецепторами, что приводит к активации врожденного иммунитета и секреции ИЛ-10, ИЛ-8, ИЛ-6, ИЛ-12, ФНО-альфа и интерферонов-альфа, -бета и –гамма, а также ускоряют созревание предшественников дендритных клеток. Кроме того, CpG ДНК бактерий способна вызывать индукцию интерферона-лямбда (интерферон 3 типа), который потенциально может представлять интерес в терапии новой коронавирусной инфекции COVID-19.
Иммунотерапевтические препараты, созданные на основе Streptococcus pyogenes, например, Пицибанил (OK-432) также обладают способностью стимулировать в организме выработку различных видов интерферона: альфа, бета, гамма.
В ряде экспериментальных исследований показана противовирусная активность, защитный эффект и уменьшение смертности препарата на основе бактерий Streptococcus pyogenes в отношении целого ряда вирусов: простого герпеса, энцефалита HSV-2, вирусом лейкоза, вируса энцефаломиокардита, вируса гепатита мыши типа 2 (MHV-2), цитомегаловируса (MCMV). Перечислим некоторые из них:
Продемонстрировано, что даже однократная внутрибрюшинная инъекция более 10 мкг OK-432, сделанная не менее чем за два дня до заражения вирусом простого герпеса, даёт заметный эффект, обеспечивая почти 100% защиту от обычно летальной инфекции. Защита не зависела от количества введённого вируса [13].
В другом экспериментальном исследовании показано, что внутрибрюшинное введение OK-432 мышам через 1 день после обработки 200 мг CY / кг предотвращало смерть от энцефалита HSV-2 в зависимости от дозы [15].
Показано, что предварительная обработка OK-432 показала выраженный супрессивный эффект на спленомегалию, вызванную вирусом лейкоза Френда у мышей [20].
Сообщается, что OK-432 был исследован на предмет его влияния на мышиный миокардит, вызванный вирусом энцефаломиокардита. Выживаемость мышей, которым вводили 1 KE OK-432 внутрибрюшинно через день, начиная с 2 дней до инокуляции вируса, была значительно выше, чем в контрольной группе мышей, которым вводили вирус один на 10–21 день (16/20 против 4/20, р < 0,001). Таким образом, OK-432, введённый до инокуляции вируса, значительно улучшил выживаемость и уменьшил как вирусный титр в сердце, так и повреждение миокарда в этой экспериментальной модели острого EMC вирусного миокардита [21].
В другом исследовании установлено, что защитное действие OK-432 на летальную инфекцию HSV, по-видимому, основано на активации NK-клеток, макрофагов и Т-лимфоцитов. При этом указывается, что защитное действие ОК-432 максимальное, если препарат вводился за 2 дня до заражения вирусом [9].
Кроме того, в другом исследовании показано, что мыши без обработки OK-432 умерли от гепатита, индуцированного инъекцией вируса гепатита мыши типа 2 (MHV-2) в течение 5 дней, тогда как мыши, предварительно инокулированные OK-432, показали выживаемость 50% [18].
Так же известно об исследовании, в котором установлено, что предварительная обработка двумя модификаторами биологического ответа (BRM) OK-432 и PS-K защищала мышей от летального исхода при заражении мышиным цитомегаловирусом (MCMV) [9].
Таким образом, можно сделать вывод, что бактерии вида Streptococcus pyogenes вырабатывают целый спектр веществ, которые являются активаторами клеточного и гуморального иммунитета человека и животных, а так же проявляют противовирусную активность, что показано в исследованиях in vivo. (Maletzki et. al., 2008). Перспективна разработка ветеринарного иммуномодулирующего препарата на основе живого непатогенного штамма Streptococcus pyogenes. Препарат на основе этих бактерий может являться иммуномодулятором для терапии иммунодефицитных состояний и вирусных инфекций у домашних и сельскохозяйственных животных.
Был получен новый непатогенный штамм Streptococcus pyogenes штамм B-7612 (патент на изобретение РФ № 2624068). Предварительные испытания показали его безвредность для лабораторных и сельскохозяйственных животных. Однако остается не выясненным вопрос о степени противовирусного действия данного препарата на животных.
Исходя из вышесказанного целью нашей работы было изучение лечебно-профилактического действия инъекционного и перорального препаратов на основе штамма Streptococcus pyogenes B-7612 при ИБК. Для этого были поставлены следующие задачи:
Материалы и методы исследования
В исследовании использовался препараты «Стрептобластолизин» и «Стрептокваша»: лиофилизированная культура живых бактерий штамм Streptococcus pyogenes B-7612 в ампулах объемом по 0,5 мл, производства КВАДРО-БИОТЕХ (патент на изобретение РФ № 2658606, патент на изобретение РФ № 2624068). Штамм Streptococcus pyogenes B-7612 депонирован в ГКПМ-Оболенск (Федеральное бюджетное учреждение науки Государственный научный центр прикладной микробиологии и биотехнологии).
Работа выполнялась в лаборатории болезней молодняка ИЭВСиДВ СФНЦА РАН в июле-августе 2020 г.
В качестве модели был выбран вакцинный штамм вируса инфекционного бронхита кур (ИБК), относящийся к семейству Coronaviridae.
В опыте использовали суточных цыплят кросса «Шавер» разделённых по принципу аналогов на три группы (n=75):
- 1 опытная группа: начиная с 12 суток опыта оральное введение препарата «Стрептокваша» в дозе 1 мл., трехкратно с интервалом 48 ч.;
- 2 опытная группа: начиная с 12 суток опыта подкожное введение препарата «Стрептобластолизин» в дозе 0,05 мл., трехкратно с интервалом 48 ч.;
- 3 группа – контроль.
На 14 сутки опыта цыплятам всех групп вводили вакцинный штамм вируса инфекционного бронхита кур (Вакцина против инфекционного бронхита кур из штамма H120 живая сухая). Производитель ФГБУ «ВНИИЗЖ» Серия 091019. Вакцину вводили перорально, индивидуально в дозе 5 lg ЭИД 40 на голову. Живая масса цыплят на момент заражения составляла 198-210 гр., водопотребление – 57 мл/сут., потребление корма – 22 гр/сут.
На 24 сутки опыта осуществили убой птицы методом цервикально-церебральной дислокации.
Для оценки лечебно-профилактическое действия препаратов производили вскрытие животных, а также взятие проб патологического материала для проведения морфологических, серологических и молекулярно-биологических исследований.
Забор крови для отбора сыворотки и определения уровня антител к вирусу инфекционного бронхита кур осуществляли в вакуумные пробирки «Body win» с активатором свертываемости, в объёме 1000 мкл от каждой птицы. Уровень антител оценивали методом ELISA c использованием тест систем PROFLOCK (Франция), и программного обеспечения Elisa 3.0
РНК выделяли двумя методами: фенол-хлороформной экстракцией и на силика-колонках с предварительным разрушением клеток гуанидин-изотиоционатом в каждом методе.
Синтез кДНК проводился, на основании особенностей постановки полимеразной цепной реакции (ПЦР), с использованием олигонуклеотида N7.
Для проведения ПЦР в режиме реального времени методом обратной транскрипции одноцепочечная молекула РНК была переведена в комплементарную ДНК (кДНК). Метод постановки ПЦР с проведением обратной транскрипции РНК в кДНК носит название ПЦР с обратной транскрипцией (ОТ-ПЦР)
ОТ-ПЦР проводили на ПЦР амплификаторе CFX96 (BioRad) в конечном объеме 20 мкл, содержащем: 67 мМ трис.-HCl (рН 8,9), 16 мМ (NH4)2SO4; 2,4 мМ MgCl2; 0,01% Твин 20; 0,2 mM дНТФ; 0,3 mкM растворы олигонуклеотидных праймеров 5`-atgctcaaccttgtccctagca-3` 5`tcaaactgcggatcatcacgt-3`, и зонда FAM-tggaagtagagtgacgcccaaac-BHQ, 1-2 ед. HotStart Taq-ДНК полимеразы. ПЦР проводили на амплификаторе CFX (BiоRad) по следующей программе: начальная денатурация - 95°С 15 мин., далее 40 циклов: денатурация - 95°С 10 сек, отжиг - 60°C 30 секунд.
Контроль выделяемости РНК из образцов проводили с использованием ПЦР в режиме реального времени специфичного в отношении мРНК гена домашнего хозяйства glyceraldehyde-3-phosphate dehydrogenase (GAPDH) по протоколу указанному выше, с использованием праймеров 5`cgtgaccccagcaacatcaa3` и 5` acttaccccagccttctccat3` taqman зонда ROX- tggagtccactggtgtcttcacc- BHQ2.
Полученные данные обрабатывали методами параметрической и непараметрической статистики.
Результаты исследования и их обсуждение
При вскрытии зараженных цыплят наиболее характерные изменения отмечены в органах дыхания и тимусе.
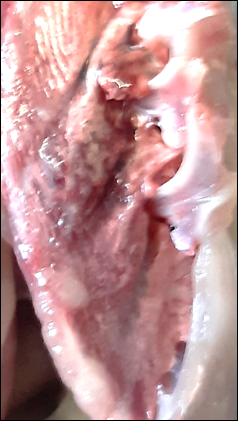
Легкие имели правильную форму. Наблюдалась отёчность, гиперемия, кровенаполненность сосудов, характерные для инфекционного ринотрахеита кур. Патологические очаги имели ромбовидную или треугольную форму, что указывает на гематогенный занос инфекционного агента (рис.1,2). При этом в трахее и бронхах видимых поражений не наблюдалось.
|
|
|
|
Рис. 1. Внешний вид легких (1 группа) |
Рис. 2. Внешний вид легких (контрольная группа) |
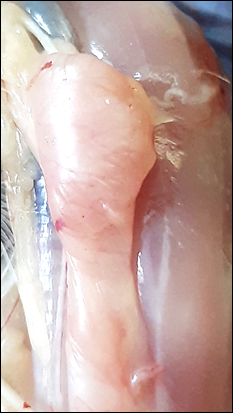
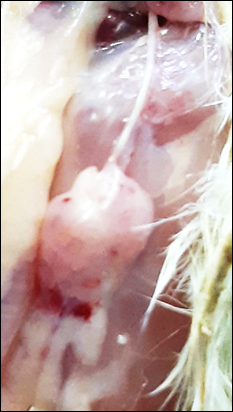
На поверхности тимуса у цыплят всех групп наблюдаются точечные кровоизлияния (рис.3,4).
|
|
|
|
Рис. 3. Внешний вид тимуса (1 группа) |
Рис. 4. Внешний вид тимуса (2 группа) |
Как видно из представленных в таблице 1 данных, наибольший процент поражения легких наблюдался у цыплят контрольной группы (84%). В первой и второй опытных группах данный показатель составляет 76 и 44% соответственно.
Таблица 1
Поражение тимуса и легких в контрольной и опытных группах, %
|
Группа |
n |
Поражено |
|||
|
Тимус |
Легкие |
||||
|
голов |
% |
Голов |
% |
||
|
Опытная группа №1 |
25 |
12 |
48% |
19 |
76% |
|
Опытная группа №2 |
25 |
19 |
76% |
11 |
44% |
|
Контрольная группа |
25 |
20 |
80% |
21 |
84% |
Аналогичная ситуация прослеживается и в отношении тимуса: у животных контрольной группы наличие патологических изменений в тимусе наблюдаются у 80% животных, в 1-опытной группе – у 48%, во 2-группе – у 76%.
Тонкий отдел кишечника у цыплят всех групп гиперемирован, наполнен переваренными кормовыми массами жидко консистенции. Толстый отдел кишечника без изменений.
Анализируя полученные результаты можно сделать вывод о том, что при экспериментальном заражении вирусом инфекционного ринотрахеита кур применение препарата «Стрептокваша» снижает риск развития патологических процессов в легких и тимусе на 8% и 22% соответственно. Подкожное введение препарата «Стрептобластолизин» в аналогичной ситуации, снижает риск развития патологий в легких на 40% по сравнению с показателями контрольной группы.
Инфицированность (отношение цыплят с детектируемым вирусом к общему количеству животных в группе), а также концентрацию геномной ДНК вируса ИБК в легких цыплят на 21 сутки опыта определяли методом ПЦР (рис.5).
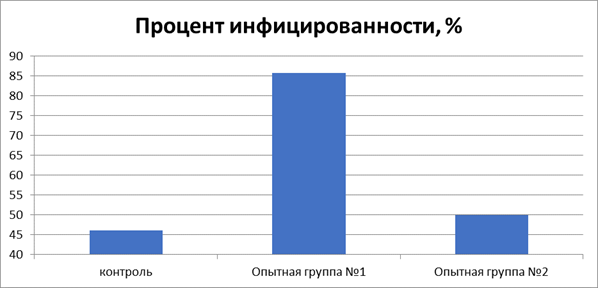
Рис. 5. Удельная доля проб легких положительных при ПЦР исследовании на ИБК, %
В первой опытной группе инфицированность легких оказалась на 39,6% выше аналогичного показателя контрольных животных, и на 35,7% - цыплят второй группы.
Несмотря на это, концентрация геномной ДНК вируса ИБК у животных первой группы оказалась существенно ниже аналогичных показателей второй опытной группы и контроля (рис.6).
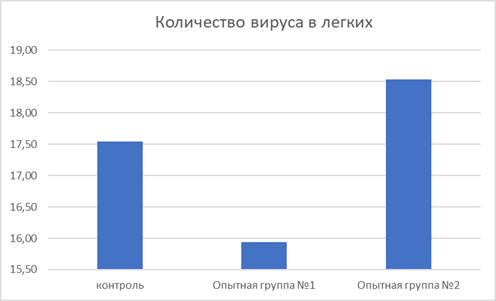
Рис.6. Количество вируса в лёгких, ddCt (IBV/Burg)
Концентрация геномной ДНК вируса ИБК, измеренная в единицах ddCt (отношение геномных последовательностей вируса к маркерным ДКН организма цыплят), была выше во второй опытной группе на 0,99 ddCt (5,6%) и ниже в первой группе - на 1,6 ddCt (9,6%) по сравнению с показателями цыплят контрольной группы.
Для изучения влияния тестируемых препаратов на иммунный ответ организма, у животных опытных и контрольной групп были взяты пробы сыворотки крови для проведения ИФА на антитела к вирусу ИБК. Результаты ИФА представлены в таблице 2.
Таблица 2
Наличие антител к вирусу ИБК в сыворотке крови цыплят
|
Группа |
n |
Кол-во животных с высоким титром антител |
Серопревалентность, % |
|
Опытная группа №1 |
25 |
18 |
72 |
|
Опытная группа №2 |
25 |
17 |
68 |
|
Контрольная группа |
25 |
15 |
60 |
Максимальное количество животных с терапевтически значимым титром антител в крови отмечается в первой опытной группе (72%). У цыплят второй группы терапевтически значимые титры антител регистрировались у 68% животных, что на 8% выше аналогичного показателя контрольной группы (60%) (рис.7).
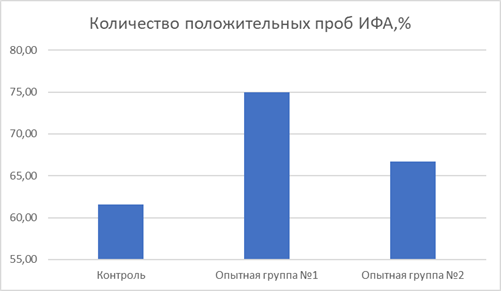
Рис. 7. Серопревалентность в отношении вируса ИБК кур, %
Анализируя полученные результаты можно сделать вывод о том, что оральное применение препарата «Стрептокваша», тормозит размножение вируса, снижая тем самым вирусную нагрузку на организм инфицированных животных. Применение данного средства с профилактической целью позволяет минимизировать поражения таргентных внутренних органов при заражении вирусом ИБК, способствует активизации иммунного ответа и выработке специфических антител, что в конечном итоге выражается в более низкой вирусной нагрузке на организм.
Подкожное введение препарата «Стрептобластолизин» по схеме указанной разработчиком, снижает риск развития патологических процессов в легких при заражении вирусом ИБК, стимулируя при этом иммунный ответ организма в виде выработки специфических антител.
Выводы
1. Оральное применение препарата «Стрептокваша» в дозе 1 мл., трехкратно с интервалом 48 ч., при заражении вирусом ИБК снижает риск развития патологических процессов в тимусе на 32% и в легких на 8% по сравнению с контролем, снижая при этом вирусную нагрузку на организм на 9,6%.
2. Подкожное применение препарата «Стрептобластолизин» в дозе 0,05 мл., трехкратно с интервалом 48 ч., при заражении вирусом ИБК снижает риск развития патологических процессов в легких на 40% по сравнению с показателями контрольной группы.
3. При экспериментальном заражении, оральное применение препарата «Стрептокваша» в дозе 1 мл., трехкратно с интервалом 48 ч., стимулирует выработку специфических антител к вирусу ИБК, увеличивая серопревалентность на 12% по сравнению с контролем.
4. Подкожное применение препарата «Стрептобластолизин» в дозе 0,05 мл., трехкратно с интервалом 48 ч., при заражении вирусом ИБК увеличивает серопревалентность на 8% по сравнению с аналогичным показателем цыплят контрольной группы.
Практические рекомендации
Для профилактики инфекционного бронхита кур, вызванного вирусом семейства Coronaviridae, рекомендуется подкожное применение препарата «Стрептобластолизин» в дозе 0,05 мл, трехкратно с интервалом 48 ч.
Препарат «Стрептокваша» рекомендуется применять при появлении клинических признаков инфекционного бронхита кур, орально в дозе 1 мл., трехкратно с интервалом 48 ч.
Данная схема уменьшает риск развития патологических процессов в органах дыхания и тимусе, снижает вирусную нагрузку на организм при появлении клинических признаков болезни, и способствует выработке специфических антител против вируса ИБК.
Авторы выражают благодарность д.б.н. В.Б. Вербицкому за оказанную помощь.
Библиографическая ссылка
Коптев В.Ю., Песня Д.С., Кадыров Р.Н. ИССЛЕДОВАНИЕ ИММУНОМОДУЛИРУЮЩЕГО И ПРОТИВОВИРУСНОГО ДЕЙСТВИЯ ПРЕПАРАТА НА ОСНОВЕ STREPTOCOCCUS PYOGENES B-7612 ПРИ ИНФЕКЦИОННОМ БРОНХИТЕ КУР // Научное обозрение. Сельскохозяйственные науки. 2022. № 1. ;URL: https://science-agriculture.ru/ru/article/view?id=68 (дата обращения: 04.03.2026).
 science-review.ru
science-review.ru